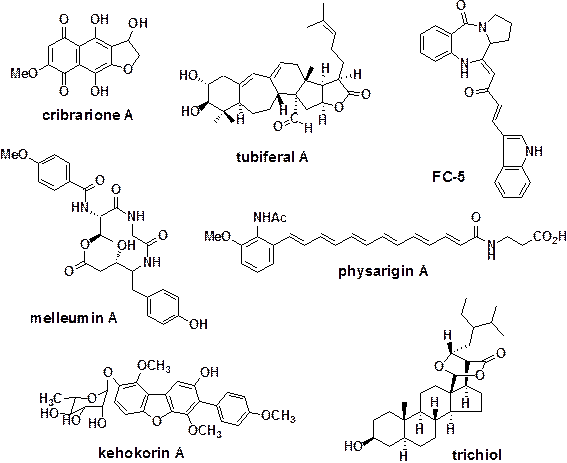Laboratory of Natural Products Chemistry
活性構造化学研究室
![]() 天然から薬をさがす
天然から薬をさがす
現在,病院や家庭で使用されている医薬品には,もともと天然の植物,微生物,動物などのからだの中に含まれている化学成分として見つけ出されたもの(天然物,天然有機化合物)がたくさんあります.また,天然の化学成分の化学構造と好ましい薬理効果をもとにして,分子構造にいろいろな改良を加えることにより,もとの天然物よりもさらに有効で安全な合成化合物も数多く開発されてきました.このように新しい化学構造と有効な生物活性をもつ天然物を探すという研究は,薬を創り出す出発点ともいうべき大変重要なことと位置付けることができます.
活性構造化学研究室では,生物活性天然物の探索を主たる研究テーマとしそれを基盤とする幅広い天然物化学研究の展開を図っています1).
1) 石橋正己,"自然のなかに薬をさがす〜千葉発の天然物研究小話",千葉日報社
![]() 包括的天然物創薬基盤研究 Comprehensive Natural Products
Chemistry
包括的天然物創薬基盤研究 Comprehensive Natural Products
Chemistry
創薬・生命科学の進展に寄与する低分子化合物の創出
天然物化学を基盤とした分子設計・探索・創製
当研究室では,未利用地球資源の開拓による独自の天然物抽出エキスライブラリーを保有しており,また,これに加えて,最近では,多様性志向型合成によるケミカルライブラリーの構築に関する研究も行っています.これら当研究室独自の化合物ライブラリーを活用して,癌などの疾患に関わるシグナル伝達分子を標的としたスクリーニングを行い,世の中から本当に要求されているもの,必要なもの,見つかったらすごいものを見つけたいと思います.
現在,私たちが行っている研究テーマとしては次のようなものがあります
1) 未利用資源の開拓および生物活性天然物の探索と構造研究
2) シグナル伝達分子を標的としたスクリーニング
3) 新規活性天然物の全合成・多様性志向型合成・ケミカルライブラリー合成
4) 生物活性低分子の活性機構解明・天然物基盤ケミカルバイオロジー
(以下は,専門的内容を含みます)
![]() 当研究室で分離された天然物
当研究室で分離された天然物
(1) 変形菌
|
|
|
|||||||||
(2) ウミウシ
|
|
|
|
|
|
Dendororis carbunculosa |
Dermatobranchus otome |
(3) 植物

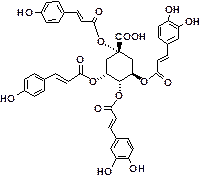
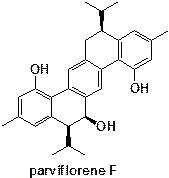
Ipomoea
pes-caprae (from
Curcuma parviflora)
当研究室では,独自に構築した未利用天然物ライブラリーを用いて,疾患関連シグナル伝達分子(疾病シグナル)を標的とした天然物の探索を行っている.ここでは,とくに主に癌に関連する三つのシグナル伝達分子TRAIL, Wnt, ヘッジホッグシグナルに関する研究についてその概要を紹介する.
1) TRAIL
シグナル1)
タイ産東北部産のショウガ科植物Curcuma
parviflora
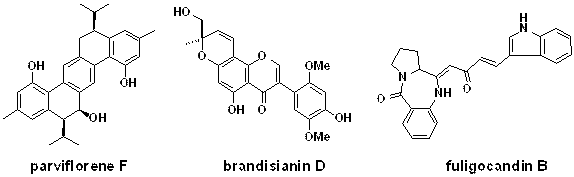
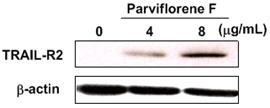
より細胞毒性をもつ一連の新規セスキテルペン二量体成分を単離した.主成分parviflorene FはTRAIL-R2 (=DR5)タンパク質の発現量を有意に上昇させ(Fig 1),またカスパーゼ-8および-3を活性化させることが明らかとなった.さらにアネキシンV染色により,本化合物によるアポトーシス誘導を確認した.従って,Parviflorene Fはデスレセプター経路を介してアポトーシスを誘導することが示唆された2). そこで,上記のデス受容体DR5
(=TRAIL-R2)に着目し,ルシフェラーゼアッセイ法を用いてDR5の発現誘導作用をもつ天然物の探索を行った.その結果,タイ産Millettia brandisiana(マメ科)より新規イソフラボノイドbrandisianin
A-Fを含む11種の化合物を単離した.これらのうち,
brandisianin Dは17.5
μMでDR5プロモーター活性を2.4倍上昇させた. またTRAIL耐性AGS細胞に対してTRAILとbrandisianin
Dの併用処理により細胞生存率が有意に減少した.この結果から,brandisianin
DはDR5の発現誘導を介してTRAIL感受性を増強させたものと示唆された3).また,TRAIL耐性細胞に対して,TRAILとの併用により細胞生存率を低下させる天然物を探索した.その結果,変形菌由来のfuligocandin BがCOX2活性化作用を介してTRAIL耐性克服作用を示すことが判明した.
|
|
|
Fig 1.Parviflorene
FによるDR5の上昇 |
2)
Wntシグナル
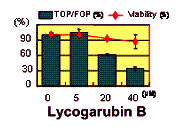
大腸癌等で異常に亢進していることが知られているWntシグナル伝達経路に着目し,その転写因子TCFの転写活性を阻害する天然物のスクリーニングを行った.TCF転写阻害活性は, TCF結合領域を有するルシフェラーゼレポータープラスミドを安定導入した293T/STF細胞株によるアッセイシステムを用いた.まず,当研究室の天然物化合物ライブラリーの中で変形菌Lycogala epidendrumの子実体より単離したlycogarubin Bが40 μM でTCF転写活性を約70%阻害することを見いだした(Fig 2).また,当研究室で合成した変形菌由来天然物の類縁体の中でcis-dihydroarcyriarubin C4)および10-epi-melleumin
B5)に顕著なTCF転写阻害活性が認められた.一方,粗抽出エキスに活性が認められたアヤメ科植物Eleutherine palmifoliaについて溶媒分画および各種クロマトグラフィーによる分画を行い,活性成分として5種の新規ナフタレン配糖体を含む15種の化合物(isoeleutherine等)を単離した.
|
|
|
Fig 2.Lycogarubin BによるTCF転写阻害 |
3)
ヘッジホッグシグナル
胚発生において重要な役割をしているヘッジホッグシグナル(Hh)伝達経路が,膵臓癌等で異常亢進していることが知られている.そこで本シグナル伝達経路に着目し,その転写因子であるGLIの転写活性を阻害する化合物を探索するために,テトラサイクリン制御システムおよびルシフェラーゼレポーターアッセイを基本とした細胞アッセイシステムを構築した.本アッセイ法を用いたスクリーニングの結果,当研究室の天然物化合物ライブラリーの中でショウガ科植物由来セスキテルペンzerumboneおよび変形菌由来staurosporinoneに顕著な活性が認められた.また粗抽出エキスに活性が認められたナス科Physalis
minimaについて活性成分の分離精製を行い,physalin
Fおよびphysalin
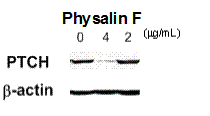
BをGLI転写阻害活性成分として単離した6).これらはテトラサイクリン制御HaCaT細胞(ヒトケラチノサイト細胞)および膵臓癌細胞PANC1において,Hh/GLI関連タンパクであるPTCHやBcl2の発現を抑制することが明らかとなった(Fig
3).抗アポトーシスタンパクであるBcl2の発現減少とGLI転写阻害の関連を明らかにしたのは初めてである.また,これらの化合物はHh/GLIが亢進しているヒト膵臓癌細胞PANC1や前立腺癌細胞DU145に対して顕著な細胞毒性を示したが,対照として用いたマウス胚由来線維芽細胞C3H10T1/2に対する細胞毒性は弱かった.本結果はGLI転写阻害活性と相関していると考えられる.
|
|
|
Fig
3.Physalin FによるPTCHタンパク質レベルの減少(PANC1細胞) |
参考文献
1) Ishibashi, M.;
Ohtsuki, T. Med. Res. Rev. 2008, 28, 688-714.
2) Ohtsuki, T.;
Tamaki, M.; Toume, K.; Ishibashi, M. Bioorg. Med. Chem. 2008, 16,
1756-1763.
3) Kikuchi, H.; Ohtsuki, T.;
Koyano, T.; Kowithayakorn, T.; Sakai, T.; Ishibashi, M. J. Nat. Prod. 2007, 70, 1910-1914.
4) Kaniwa, K.; Arai, M.
A.; Li, X.; Ishibashi, M. Bioorg. Med. Chem. Lett. 2007, 17,
4254-4257.
5) Hanazawa, S.; Arai, M. A.; Li,
X.; Ishibashi, M.
Bioorg. Med. Chem. Lett.
2008, 18, 95-98.
6) Hosoya,
T.; Arai, M. A.; Koyano, T.; Kowithayakorn, T.; Ishibashi, M. ChemBioChem 2008, 9, 1082-1092.
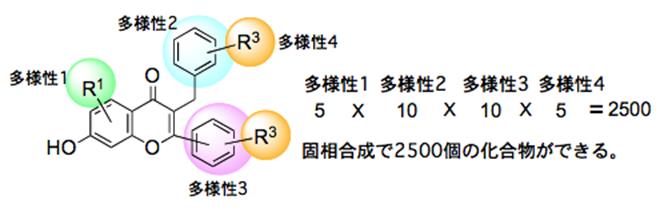
天から与えられた化合物骨格をベースに、数百〜千の化合物を合成する。
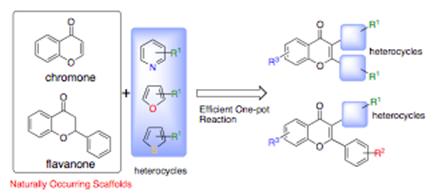
様々な有用な活性を有するクロモン、フラボノイドにさらにタンパク質との相互作用が期待できるヘテロ環置換基を導入。ワンポットで効率的に合成できる方法を確立した。
固相合成を利用して下のように、たくさんの化合物を一気に創る事がきます。
この反応は固相でもうまく進行することがわかりました。現在ライブラリーを合成中。癌細胞毒性、ヘッジホッグ阻害活性、神経幹細胞の分化活性化などの活性を有する化合物をすでに見出しています。
(フラボノイドの効率的合成法を開発。特許出願中)
The one-pot synthesis by Michael-aldol reaction of chromone and
flavonoid derivatives with diverse heterocyclic units.
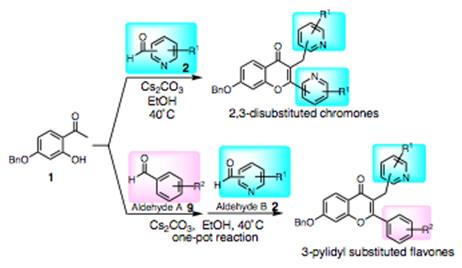
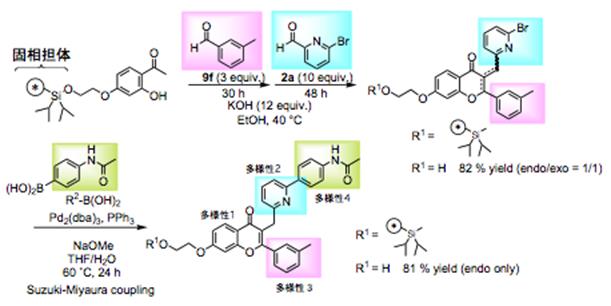
固相反応でもスムーズに進行します。
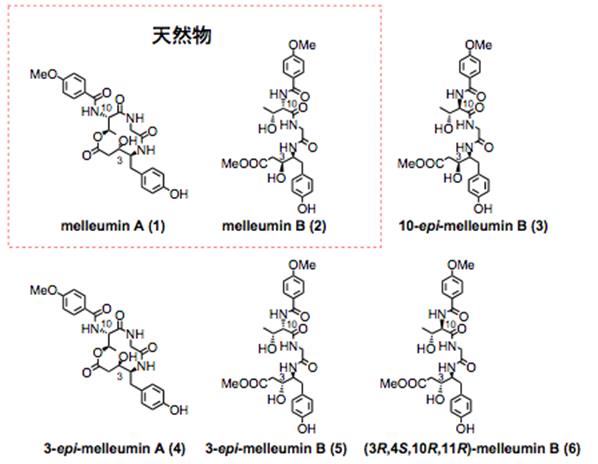
変形菌から単離された天然物とその誘導体の合成と、Wntシグナル阻害活性
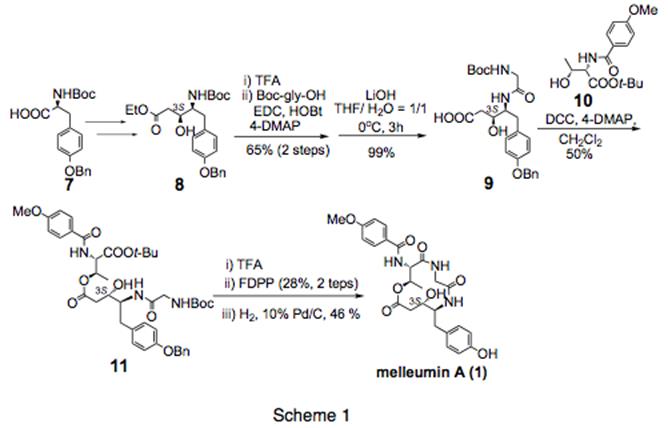
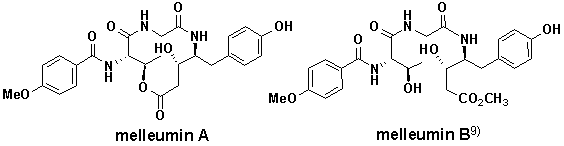
Physarum melleum培養変形体よりmelleumin A (1) 1.9 mgおよび セコ酸エステルmelleumin B (2) 6.5 mgが単離され,1, 2の全合成とともに、melleuminsの立体異性体である,10-epi-melleumin B (3), 3-epi-melleumin A (4),3-epi-melleumin B (5), (3R, 4S,10R,11R)-melleumin
B (6)の合成を行った (Fig. 1).細胞を用いたルシフェラーゼレポーター遺伝子による,Wntシグナル転写活性阻害では,10-epi-melleumin
B (3), 3-epi-melleumin B (5), (3R,4S,10R,11R)-melleumin
B (6) において,中程度のWntシグナル阻害活性を見出した.
Fig. 1 Structures of melleumin A, B and their
isomers.
当研究室で単離され全合成された天然物

参考文献
7)
Akiyama, K.; Yamamoto, S.; Fujimoto, H.;
Ishibashi, M. Tetrahedron 2005, 61, 1827-1833.
8)
Kaniwa, K.;
Arai, M. A.; Li, X.; Ishibashi, M. Bioorg. Med. Chem. Lett. 2007,
17, 4254-4257.
9)
Hanazawa, S.; Arai, M. A.; Li, X.; Ishibashi, M.
Bioorg. Med. Chem. Lett. 2008, 18,
95-98.
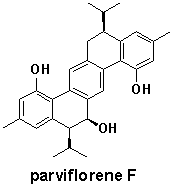
![]() カジナン二量体parviflorene Fのアポトーシス誘導作用の解析
カジナン二量体parviflorene Fのアポトーシス誘導作用の解析
当研究室における生物活性天然物の探索の一環として,これまでにタイ東北部産のショウガ科植物Curcuma parvifloraより新規炭素骨格をもつ一連のセスキテルペン二量体型成分parviflorene A-Jを単離した.10-13) また,これらは培養腫瘍細胞(KB,
HeLa, KOB, P388, LNCaP)に対して細胞増殖抑制活性を示したため,主成分parviflorene F についてDNAマイクロアレイ,リアルタイムRT-PCRを用いたがん疾患関連遺伝子発現解析を行った.その結果,アポトーシスに関与するデス受容体DR5 (TRAIL-R2)遺伝子の発現を未処理群と比較し4.9倍上昇させることが判明した.
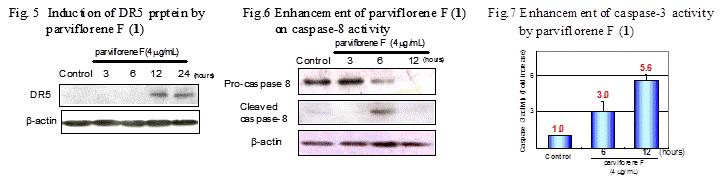
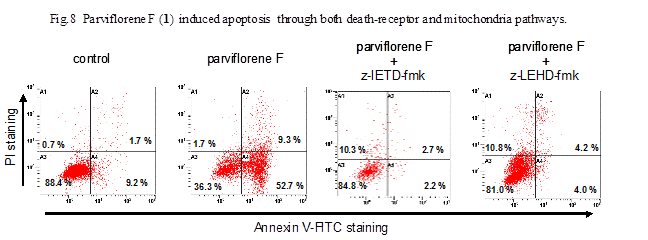
そこで,parviflorene F のアポトーシス誘導機構を明らかにするため,アポトーシスシグナルカスケードのうちデスレセプター経路に関わるタンパクについて,parviflorene F処理(4 μg/mL)3,6,12及び24時間後の発現変化を調べた.その結果,parviflorene F処理後12時間から24時間にかけてDR5の発現量が増加することが判明した(Fig.5).一方,parviflorene F処理後6時間でprocaspase-8 (55/57 kDa)の減少及びcaspase-8(42 kDa)の増加も観察された(Fig.6).また,caspase-3活性について,蛍光合成基質であるZ-DEVD-ローダミン110を用いて検討を行った結果,経時的な活性誘導が確認され,特に処理後12時間で約5.6倍有意な活性の上昇が認められた(Fig.7).さらに,フローサイトメトリー法を用いたAnnexin V-PI二重染色法によってAnnexin V陽性細胞群の増加が観測され,アポトーシスが誘導されることが確認された(Fig.8).また,caspase阻害剤であるz-IETD-fmk (caspase 8 阻害剤)及びz-LEHD-fmk (caspase 9阻害剤)を併用したところ,parviflorene Fによるアポトーシス誘導が顕著に抑制された(Fig.8).以上の結果から,parviflorene Fのアポトーシス誘導にはデスレセプター経路,ミトコンドリア経路両経路を介することが示唆された.14)
参考文献
10) Takahashi,
M.; Koyano, T.; Kowithayakorn, T.; Hayashi, M.; Komiyama, K.; Ishibashi, M. Tetrahedron
Lett. 2003, 44, 2327-2329.
11) Toume, K.; Takahashi, M.; Koyano, T.; Kowithayakorn,
T.; Yamaguchi,
K.; Hayashi, M.; Komiyama, K.; Ishibashi, M.
Tetrahedron 2004, 60, 10817-10824.
12)
Toume, K.; Sato, M.; Koyano, T.; Kowithayakorn,
T.; Yamori,
T.; Ishibashi, M. Tetrahedron 2005,
61, 6700-6706.
13)
Tamaki, M.; Sadhu, S. K.; Ohtsuki, T.; Toume, K.; Koyano, T.; Kowithayakorn,
T.; Ishibashi, M. Heterocycles 2007, 72, 649-654
14)
Ohtsuki, T.;
Tamaki, M.; Toume, K.; Ishibashi, M. Bioorg.
Med. Chem. 2008, 16,
1756-1763.