放射性医薬品は放射性核種(RI)を用いた医薬品です。γ線やβ+線を放出するRIを用いた薬剤は画像診断に、β−線やα線を放出するRIを用いた薬剤は核医学治療に用いることができます。当研究室は、がんの診断や治療を目的とした放射性医薬品を、有機反応を駆使することで作製し、作製した薬剤を細胞実験や動物を用いた動態試験によって評価しています。現在、当研究室で進めているメインプロジェクトは以下の2つです。
RI標識低分子抗体の腎集積低減
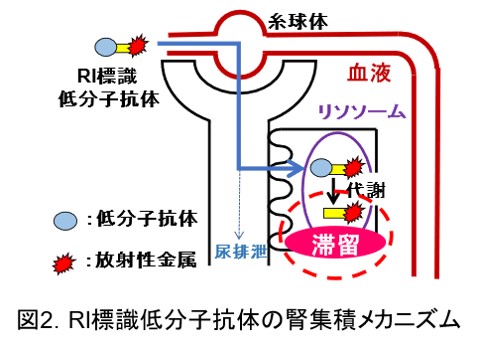
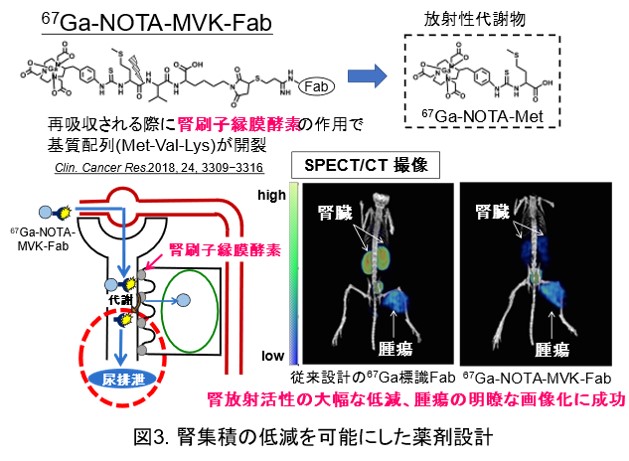
抗体のFabフラグメントなどの(図1)低分子ペプチドは抗体と比較して速やかな血液クリアランス、腫瘍集積を持つことから、がんの画像診断への応用が期待されます。一方で、RI標識低分子ペプチドは腎臓に長時間放射活性が滞留することによる画像診断精度の低下や腎臓への毒性が問題となります。特に腎臓への毒性は治療薬の投与量の制限につながることから、腎集積の低い薬剤の開発が求められています。腎臓への滞留は糸球体ろ過を受け、近位尿細管から再吸収されたRI標識低分子抗体がリソソームで代謝を受け、生成した放射性代謝物が腎細胞内に滞留することが原因です(図2)。この問題に対し、所属研究室では細胞膜上に発現している腎刷子縁膜酵素に着目し、腎刷子縁膜酵素の作用により尿排泄制の放射性代謝物を有利することで、腎放射活性を低減する薬剤設計を開発してきました。その中の一例として、放射性ガリウムを用いた薬剤として、67Ga-NOTA-MVK-Fabを示します(図3)。この薬剤は腎刷子縁膜酵素の作用で代謝性配列であるMVKのMet-Val間が開裂し、尿排泄性の高い放射性代謝物Ga-NOTA-Metを遊離することで、基質配列を持たない従来設計のGa標識Fabと比較して腎放射活性を投与早期から大幅に低減し、投与3時間後のSPECT/CT撮像では腫瘍の明瞭な画像化に成功しました。このような薬剤設計を、他の放射性核種や、多様な低分子ペプチドに応用し、診断精度が高く、副作用の少ない核医学診断・治療薬剤の開発を目指しています。
211Atを用いたα線治療薬剤の開発
放射線の一種であるα線は、飛程(放射線の飛ぶ距離)が短く、その間に多くのエネルギーを与えることから、α線放出核種を腫瘍組織に選択的に集積させることができれば、高い治療効果が期待できるとともに、周囲の正常組織への影響は小さく抑えることが期待できます。そのため、α線放出核種を用いた標的α線治療が注目され、現在数多くの研究が行われています。α線放出核種の一つであるアスタチン-211(211At)は、本邦において最も多く製造されているα線放出核種であり、我々は、211Atを用いた標的α線治療薬剤の研究を進めています。従来、211At標識部位にはastatobenzoateが汎用されていましたが、この構造を持つ薬剤を生体に投与するとベンゼン環から211Atが脱離し、肺や脾臓、甲状腺、胃に211Atが集積し、これらの臓器において副作用が生じる恐れがありました。この問題に対して我々は、211At標識薬剤の安定性を高める標識母体構造を開発しました。本標識母体を持つ薬剤は、従来のastatobenzoate型の薬剤と比較して、211At脱離に対して安定であり、脱離した211Atが集まる胃や脾臓への集積を大幅に低減することに成功しました。本標識母体とがん集積能を持つ分子と組み合わせた新たなα線治療薬剤を設計・合成し、副作用の少なく治療効果の高い核医学治療薬剤の開発を目指しています。
